虽然许多疾病可以在实验室的简单环境中得到有效治疗,但要在真实的生物体内取得成功,药物必须在复杂的生理环境中顺利运输,并安全到达受影响的细胞。这一过程被称为药物输送,是医学领域面临的重大挑战之一。
劳伦斯伯克利国家实验室与罗氏集团旗下的基因泰克公司正在合作,致力于设计更高效的脂质纳米颗粒(LNPs),这些微小的球形囊泡由脂肪分子构成,能够将治疗药物包裹在细胞膜上,直到它们与细胞膜结合并释放药物。2018年,首个使用LNPs的药物获得批准,而随着辉瑞和Moderna的mRNA COVID疫苗的推出,这种递送方式在全球范围内引起了广泛关注。
“这是一个相当智能的系统,因为如果仅仅将RNA传递给人体,RNA会被核酸酶降解,并且由于其大小和电荷,难以穿过细胞膜,而LNPs则能够安全地将其送入细胞,”基因泰克小分子制药科学小组的高级首席科学家Jun-Wan Yen解释道。
目前,LNPs正被广泛研究作为其他传染病疫苗或癌症治疗疫苗的递送系统。这些新应用的可行性将取决于脂质包膜与靶细胞融合的效率、药物-LNP制剂在储存中的稳定性(以确保其具有较长的保质期),以及它们在体内的稳定性(以延长药物的活性)。
所有这些特性均由用于制造LNP的分子组合及其形成的粒子三维结构所决定。Yen与他的同事Greg Hura和Michael Hammel领导的团队,都是伯克利实验室的生物物理学家,近年来一直在研究如何调整LNP的结构以实现预期的性能。
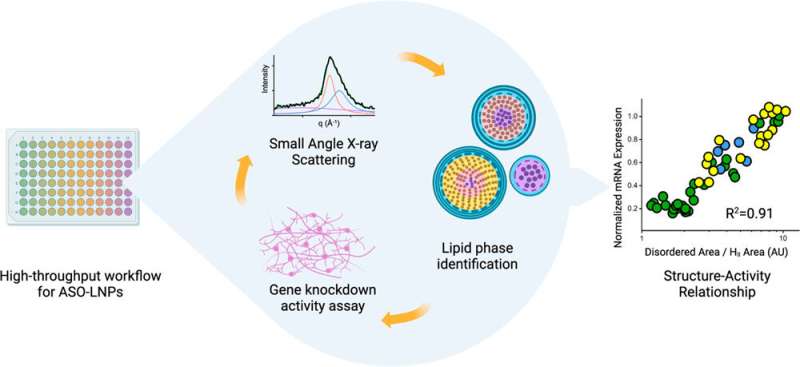
他们最近在《ACS Nano》上发表的论文记录了高通量工作流程如何使他们以创纪录的速度生产和表征LNPs。该研究首次展示了LNP的结构与其内容物(反义寡核苷酸(ASO))的活性之间的关系。ASO是RNA或DNA碱基对的小片段,通过与mRNA链结合并阻止其翻译成蛋白质,从而抑制基因表达。ASO是治疗由蛋白质缺陷或过剩引起的疾病的有效方法。然而,像mRNA一样,它们也容易受到流动的核酸酶(降解RNA和DNA的酶)的影响,细胞对它们的吸收也较为困难。
研究人员发现,与结构较为混乱的LNPs相比,携带ASO的LNPs具有整齐有序、紧密排列的内部结构,能够更有效地沉默人类神经元中与退行性疾病相关的缺陷基因。这些发现基于细胞活动,而非动物研究,因此仍需进一步探索,但团队很高兴能够利用各自机构的互补工具来获得这些见解。
“我们生成高通量LNP,Greg和Michael的团队能够提供高通量分析,”Yen表示。“如果你查看当前的文献,通常只会涉及一两个配方,但对我们来说情况不同。我们能够生成大型数据集,我认为这就是我们能够取得如此独特和令人兴奋的发现的原因。”
“这篇论文确实提出了一种方法,我们将应用于我们打算表征的数千种其他配方,”Hura补充道,他是伯克利实验室生物科学领域的一员。“我们希望这将成为优化脂质纳米颗粒的通用方法。无论是疫苗还是其他治疗方法,迄今为止,疫苗受到了最大的关注。此外,这种疗法还有非常广泛的应用前景。”
如何构建脂质纳米颗粒
本文来自作者[admin]投稿,不代表zwrqa号立场,如若转载,请注明出处:https://wap.zwrqa.cn/zlan/202507-1311.html


评论列表(4条)
我是zwrqa号的签约作者“admin”!
希望本篇文章《通过优化脂质纳米颗粒突破药物传递的瓶颈》能对你有所帮助!
本站[zwrqa号]内容主要涵盖:国足,欧洲杯,世界杯,篮球,欧冠,亚冠,英超,足球,综合体育
本文概览:虽然许多疾病可以在实验室的简单环境中得到有效治疗,但要在真实的生物体内取得成功,药物必须在复杂的生理环境中顺利运输,并安全到达受影响的细胞。...